يون کلسيم نقش قاطعي در تنظيم فرايندهاي سلولي دارد. براي مشخص شدن تنوع عملکرد يون کلسيم لازم است بدانيم که سيستم هاي سيگنالينگ در حالت هاي مختلفي عمل ميکنند بنابراين امکان عملگري در رنج ديناميکي وسيعي را فراهم ميکنند. ميتوانند اگزوسيتوز در انتهاي سيناپسي را در حد ميکروثانيه راه بياندازند و انقباض ماهيچه را در مدت ميليثانيه، در حاليکه در طرف ديگر ميتواند در حدود دقيقه تا ساعت فرايندهاي نظير بيان ژن و تکثير سلول را راه اندازي کند. اين تنوع به اين بستگي دارد که هر نوع سلول مکانيسم هاي سيگنالينگ کلسيمي مخصوص به خود را دارد که در آن عوامل متنوعي (Toolkit) نقش دارند. يکي از چالش ها دانستن اين موضوع است که چطور اين سيستم هاي سيگنالينگ کلسيم به طور گسترده فرايندهاي سلولي مختلف را کنترل ميکنند؟
در هر لحظه از زمان، سطح کلسيم درون سلولي توسط برقراري تعادل بين واکنش هاي «on» وارد کننده کلسيم به درون سيتوپلاسم و واکنش هاي “off” که سيگنال کلسيم را توسط فعاليت ترکيبي بافرها، پمپ ها ومبادله کننده ها حذف ميکند، مشخص ميشود. در طول واکنش«on» ، نسبت کمي از کلسيم به افکتورهايي باند ميشود که مسئول تحريک فرايندهاي وابسته به کلسيم هستند.
ابزارهاي مؤثر در سيگنالينگ کلسيم
(Calcium Toolkits)
براي شروع سيگنالينگ کلسيم يا اثرگذاري در مسير آن نياز به يک سري عوامل حساس به کلسيم است. اين ابزار و عوامل در اينجا با توجه به نقشي که در اين مسير دارند و نحوه مشارکتشان دسته بندي شدهاند:
گيرنده هاي سطح سلول
گيرنده هاي بسياري نظير (G Protein Coupled Receptor) Gpcr و Ptkr (Protein Tyrosine Kinase Linked Receptor) وجود دارند که ايزوفرم هاي مختلف Plc (Phospholipase C) کوپل ميشوند که Insp3 پيامبرهاي ثانويه محرک کلسيم را توليد ميکند
سنسورهاي کلسيمي
نقش پيامبر ثانويه يون کلسيم توسط رنج وسيعي از سنسورها که تغييرات غلظت کلسيم را تشخيص ميدهند و سپس پاسخ هاي متنوعي را فعال ميکنند انجام ميشود. بيشتر اين سنسورها به دو گروه عمده اند با توجه به داشتن EF-Hand يا دامنه باندينگ کلسيم به C2.
بافرهاي کلسيمي
ويژگي هاي زماني و مکاني سيگنال هاي کلسيم توسط باندينگ سريع آنها به اين بافرها شکل ميگيرد. بافرهاي ER امکان ذخيره کلسيم زياد براي فرايندهاي سيگنالينگ سريع را فراهم ميکند. ميتوکندري نيز با بيان MCU که مقدار زيادي کلسيم را هر زمان که سطح سيتوزول بالا رفت، بالا ميبرد و سپس توسط تبادلگرNa+/Ca2+ بيرون برده ميشود.
کانال هاي کلسيمي
کانال هاي عبوردهنده کلسيم هم در غشاي سلول و هم در غشاي اندامک هاي درون سلولي قرار دارند. کانال هاي وابسته به ولتاژ
VOC (Voltage operated channels) به سه گروه تقسيم ميشوند.Cav1 ، Cav2 ، Cav3 به ترتيب کانال نوع L ،نوعR و نوع T هستند که عملکرد مختلفي در انواع سلول ها دارند. همچنين کانال هايي وجود دارند که توسط يک آگونيست که از بيرون ميآيد يا حاصل تحريک درون سلولي است فعال ميشود. آزاد شدن از ذخاير درون سلولي يک منبع عمده سيگنال Ca در بسياري از سلول هاست. قسمت عمده ذخيره کلسيم در شبکه ER است که هر دو گروه RYR وInsP3R را شامل ميشود. اين کانال ها توسط کلسيم فعال ميشوند. همچنين ذخاير اسيدي وجود دارد که گروه TPC را شامل ميشوند که توسط NAADP فعال ميشوند.
دسته ديگري از کانالها، کانال هاي ولتاژي فعال شونده با کلسيماند که با نماد BKca مشخص ميشوند. اين کانال ها در مغز، ماهيچه اسکلتي و نرم، شش و غيره حضور دارند. از ويژگي هاي اين کانال ها موارد زير است:
a- رسانايي متغير
b- فعال شدن متداول با مکانيسم هاي وابسته به Calmodulin
c- کوپلينگ متداول با کانال هاي کلسيمي وابسته به ولتاژ به طوريکه شار کلسيم کانالهاي BKca را فعال کند.
d- فعال شدن در مرحله بعد از هايپرپلاريزاسيون در نورون ها
پمپ هاي کلسيمي و تبادلگر ها
پمپ ها و تبادلگرها مسئول پمپاژ کلسيم به بيرون يا درون سلول يا ER اند. اين پمپها و تبادلگرها در زمان هاي مختلف در طول فرايند ريکاوري عمل ميکنند.
تبادلگر Na+/Ca2+ جاذبه (ميل ترکيبي) کمي به کلسيم دارد اما ظرفيت بالايي دارند و اين باعث ميشود که در ابتداي فرايند ريکاوري عمل کند و به سرعت کلسيم هاي زيادي را خارج کند. به طور خاص در سلول هاي تحريک پذير ديده ميشود. از سوي ديگر PMCA (Plasma membrane ca ATPase) و SERCA پمپ هاي ظرفيت پايينتري هستند ولي تمايل بالاتري دارند که به اين معني است که ميتواند فرايند ريکاوري را کامل کنند و به پمپاژ کردن تا رساندن مقدار آن به حد 100 نانومولار ادامه دهند.
اصلاح سيستم هاي سيگنالينگ يون کلسيم
زمانيکه سلول تمايز پيدا ميکند مجموعه واحدي از عوامل مؤثر در سيگنالينگ را براي ايجاد سيستم هاي سيگنالينگ کلسيم با ويژگي هاي زماني و مکاني بسيار متنوع بيان ميکند. اين سيستم هاي سيگنالينگ به طور ثابت قرار نميگيرند و به طور مداوم در حال بازسازي براي تطبيق با تغيرات موقعيت هستند تا اطمينان حاصل شود که هر نوع خاص سلولي به دريافت سيگنال هاي کلسيم که عملکرد انحصاري آن را مشخص ميکند ادامه ميدهد.
اگر شرايط زماني-مکاني اين سيگنال هاي خروجي در اثر اختلال در يک جزء تغيير پيدا کند مکانيسم هاي جبرانگر وارد عمل ميشوند تا سيگنال طبيعي خروجي را بازسازي کنند. اين فرايند بازسازي نشانگر اين است که کيفيت سيگنال خروجي تحت بازنگري ثابتي است. در اين مکانيسم ارزيابي کلسيم نقش مهمي دارد. پروتئين حساس به کلسيم Calcineurin فاکتور رونويسي NFAT را که نقش مهمي در اين مکانيسم دارد فعال ميکند. بازسازي غيرمعمول سيگنال کلسيم ميتواند منجر به بيماري شود.
به نظر ميرسد که هر سلول يک طرح سيگنالينگ دارد و دقيقاً ميداند انتظار دارد چه نوع سيگنالي دريافت کند. اگر خواص Spatio-Temporal اين سيگنال خروجي به علت از دست دادن يا نقص يک جزء کليدي تغيير کند، مکانيزم هاي جبران کننده براي بازيابي سيگنال خروجي نرمال فعاليت ميکنند. اين فرآيند بازسازي نشان ميدهد که يک عنصر ارزيابي کيفيت وجود دارد که توسط ان خروجي سيستم سيگنالينگ به طور مداوم نظارت ميشود. فرضيه ما اين است که خود Ca2 + در اين مکانيزم ارزيابي داخلي با اصلاح مسير سيگنالينگ خود نقش دارد.
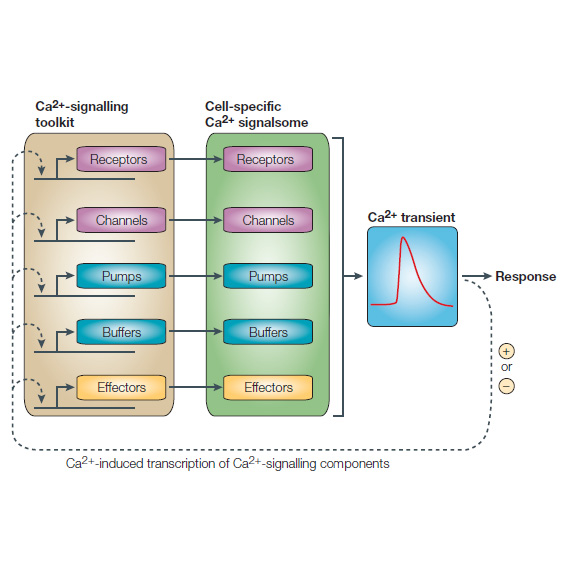
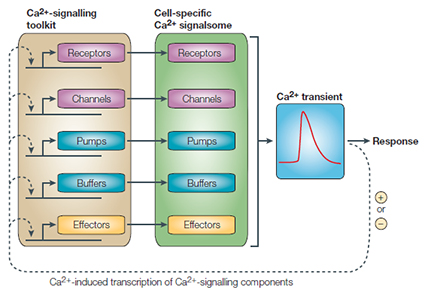 تصوير 1 – فرضيه بازسازي کلسيم-سيگنالينگ توسط کلسيم.
تصوير 1 – فرضيه بازسازي کلسيم-سيگنالينگ توسط کلسيم.
Signalsome هاي اختصاصي يون کلسيم در سلول که با انتخاب اجزاي مجموعه عوامل سيگنالينگ يون کلسيم (BOX 1) توليد ميشوند سيگنال هاي گذراي يون کلسيم که براي هر نوع سلول مشخص اند را توليد مي کنند. پيشنهاد شده است که پاسخ گذراي Ca2 + دو عملکرد دارد. علاوه بر فعال کردن پاسخ هاي سلولي، آن نيز به عنوان بخشي از مکانيسم فيدبک براي تنظيم رويدادهاي رونويسي که مسئول حفظ سيگنالوزوم هستند عمل ميکند. اين تنظيمات رونويسي وابسته به Ca2 + ممکن است يک نقش مرکزي در مکانيسم هاي جبران کنندهاي داشته باشد که سلول ها را قادر ميسازد تا با هر تغييري از يون کلسيم در سيستمهاي خود سازگار شوند. به نظر ميرسد که Ca2 + ميتواند فعاليت هاي رونويسي را مثبت و منفي تنظيم کند. بيماري هايي مانند افسردگي مانيک، فشار خون بالا، ديابت و نارسايي احتقاني قلب ممکن است از خطا در عملکرد اين سيستم پيشنهادي بازسازي فنوتيپي ناشي شود.
تکثير سلولي
کلسيم نقش مهمي در طول چرخه سلولي و به خصوص در G1 و در مرز G1/S و G2/M دارد. در G1 ،G1/S و M تغيير در غلظت کلسيم درون سلولي مشاهده ميشود. نياز به کلسيم، زماني مشخص ميشود که غلظت کلسيم خارج سلولي از mM 1به 0.1 mM کاهش داده شد و فرايند تکثير متوقف شود.
در G1 سلولها بيشتر به کاهش غلظت کلسيم خارج سلولي حساساند و اين مرحله براي بيان ژنهاي اوليه مانند FOS، JUN و MYC مهم است. و در مرتبه بعد در مرز G1/S که در آن کلسيم براي فسفريلاسيون RB1 نياز است.
در طول G1 و M به CaM نياز است و مهارکننده هاي CamK پيشرفت چرخه سلولي را در ابتدا يا انتهاي G1 متوقف ميکنند. مهار شدن Camk منجر به کمبود بيان CCND1 افزايش بيان P27مهار CDk4 و CDK2 و در نتيجه توقف G1 ميشود.
Calcineurin نقش مهمي در پيشرفت در فاز G1 و S دارد. مهار آن با افزايش بيان P21، فعاليت CDK2 را suppress ميکند. همچنين بيان فاکتورهايي که G1/S را کنترل ميکنند، تنظيم ميکند همچنين ميتواند در بيان ژن نقش داشته باشد. سيگنال کلسيم حاصل از فضاي خارج سلولي يا ذخاير درون سلولي ميتواند Calcineurin را فعال کند. در نهايت طي مسيري بر بيان ژن اثر بگذارد (مسير NFAT). در سرطان پروستات ژن هايي هست که حاصل از همين مرحله بيان ژن ناشي از مسير NFAT است.
چسبندگي
از جمله پروتئين هاي مؤثر در چسبندگي ميتوان اينتگرين، کادهرين و CAM را نام برد. در اينجا به تفکيک، ارتباط هر کدام با يون کلسيم را بررسي ميکنيم. مولکول هاي CAM نقش ضروري در توسعه و تکامل مغز با تنظيم مهاجرت، تمايز، تشکيل سيناپس و غيره دارند. CAM ها به واسطه تعدادي از سيگنالينگ هاي درون سلولي که شامل تغيير در پيامبرهاي ثانويه است مانند تغيير در سطح کلسيم درونسلولي در رفتار نورون اثر ميگذارند. يون کلسيم يک مولکول ثانويه ضروري سيگنالينگ درون سلولي است.
مهاجرت
مهاجرت از چند فرايند همزمان تشکيل شده است که شامل تشکيل نقاط چسبندگي کانوني (Focal Adhesion)، قرارگرفتن غشا در لبه پيش روي سلول، ايجاد نيروي دورن سلولي توسط پليمرازسيون اکتين، جداسازي چسبندگي کانوني و بازيابي توده غشا در انتهاي سلول است. اين فرايندهاي ديناميک به رخدادهاي سيگنالينگ درون سلولي مثل شارش کلسيم نياز دارند.
اکسيداسيون کلسترول LDL باعث توليد محصول ثانويه LysoPC ميشود که باعث افزايش غلظت کلسيم درون سلولي از طريق اثرگذاري بر سنسور کلسيمي Calpain ميشود. اين سنسور کلسيمي بايد دقيقاً در مکان ها و زمان هاي خاصي فعال شود و براي مهاجرت معمول سلول نياز است. اين سنسور قابليت جداسازي پروتئين هاي اسکلت سلولي و اجزاي اينتگرين را دارد. Calpain براي جداسازي انتهاي سلول و ايجاد Lamellipodia در حرکت رو به جلوي سلول نياز است. اگر اين ماده زياد بيان شود ميتواند مهاجرت را با افزايش نقاط چسبندگي يا با تخريب بيش از حد پروتئين مهار کند.
آپوپتوز
Ca2 + يکي از تنظيمکنندههاي اصلي بقاي سلولي است، اما Ca2 + همچنين ميتواند در پاسخ به شرايط مختلف، پاتولوژيک آپوپتوز را القا کند. اثرات آپوپتوزي Ca2+ به واسطه طيف متنوعي از فاکتورهاي حساس به Ca2+ که در اندامک هاي مختلف داخل سلولي شامل ER، سيتوپلاسم و ميتوکندري توزيع شدهاند، رخ ميدهد. به نظر ميرسد ديناميک Ca2+ در اين اندامک ها توسط پروتئينهاي تنظيمکننده آپوپتوز (از خانواده (Bcl-2 تنظيم ميشود.
به محض اينکه تحقيقات در مورد کلسيم و آپوپتوز افزايش يافت، کلسيم يونيزه به عنوان يک پيام رسان اصلي درونسلولي و همچنين به عنوان يک عامل براي مرگ سلول هاي نکروتيک در شرايط افزايش بيش از حد کلسيم سلولي شناخته شد. بنابراين، توجه زيادي به مکانيزم هاي سيگنالينگ معطوف شده است که تغييرات در کلسيم را به رخداد آپوپتوز متصل ميکنند و اجازه ميدهد بتوان بين بقاي سلولي، آپوپتوز و اثرات القاء نکروز توسط کلسيم تفاوت قائل شد. اگر چه کار در اين راستا کامل نيست، لينک هاي متعددي که کلسيم را به مسيرهاي بيروني، دروني و ER متصل ميکنند، شناسايي شدهاند. علاوه بر اين ثابت شده است که فعال سازي انتخابي يک مسير خاص بقا يا مرگ سلولي توسط کلسيم از الگوي مکاني و فضايي تغييرات در [Ca2+] در درون سلول استفاده ميکند و به طور همزمان کلسيم و ساير سيگنال ها را تشخيص ميدهد. مطالعات انجام شده در اين راستا به شدت به توسعه تکنولوژيهاي تصويربرداري ميکروسکوپي که امکان مشاهده سيگنال هاي سلولي را در ابعاد تک سلولي يا درون سلولي فراهم ميکند، وابسته است.
توزيع کلسيم درون سلولي : مرگ و بقاي سلول
غلظت کلسيم آزاد درون سلولي حدود 100 نانومولار است که نسبت به غلظت خارج سلولي بسيار کمتر است. مکانيسم هاي عمده در غلظت کم کلسيم درون سلولي خروج کلسيم توسط پمپ هاي کلسيمي غشا و تبادلگرهاي سديم/کلسيم است. غلظت کلسيم در ماتريکس هسته و در ماتريکس ميتوکندري نيز مشابه غلظت درون سلولي است. با اين حال، ديگر اندام هاي داخل سلولي، گراديان غلظت Ca2 + بالايي نسبت به سيتوپلاسم دارند. در بيشتر سلول ها مهمترين بخش ذخيره سازي Ca2 + در سلول، شبکه اندوپلاسمي (در سلولهاي عضلاني شبکه سارکوپلاسمي) است.
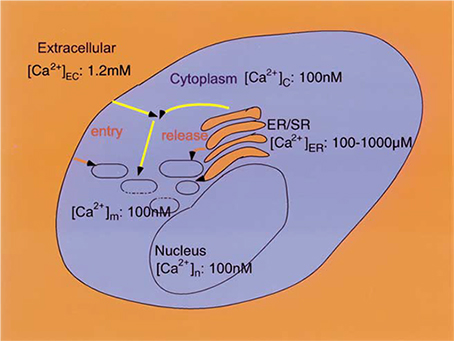 تصوير-2 توزيع کلسيم درون سلولي
تصوير-2 توزيع کلسيم درون سلولي
يکي از متداولترين سيگنالهاي درون سلولي افزايش هدفمند غلظت کلسيم درون ماتريکس هسته، ميتوکندري و سيتوپلاسم است. با اين حال افزايش طولاني مدت در توزيع کلسيم شامل افزايش غلظت کلسيم درون ماتريکس هسته، ميتوکندري و سيتوپلاسم و کاهش در کلسيم شبکه اندوپلاسمي ميتواند منجر به رخداد فرايندهاي متوالي متنوعي شود که باعث مرگ سلول ميشود. فعال شدن کانال هاي آزادکننده کلسيم در شبکه ER يا SR ،
گيرنده هاي IP3 (IP3Rs)، گيرندههاي ryanodine (RyRs) باعث کاهش غلظت کلسيم شبکه اندوپلاسمي و افزايش غلظت درون سلولي ميشود. افزايش فعاليت کانال هاي کلسيمي غشاي سلول به حرکت کلسيم در جهت غلظت و گراديان الکتريکي اجازه عبور ميدهد و باعث افزايش غلظت کلسيم درون سلولي ميشود. حفرات بزرگ غشاي هسته، امکان تغيير غلظت کلسيم در هسته متناظر با تغيير در غلظت کلسيم درون سلولي را ميدهند. ماتريکس ميتوکندري توسط غشاي دو لايه از محيط درون سلولي جدا شده است و غشاي دروني (IMM) نفوذپذيري کمي نسبت به يون ها دارد. افزايش ميتواند باعث ايجاد و ورود کلسيم به داخل ميتوکندري شود.
اثر کلسيم بر ماتريکس هسته، ميتوکندري و شبکه اندوپلاسمي ميتوکندري
ابتدا دو مسير ورود و خروج يون کلسيم در ميتوکندري در اينجا معرفي ميشود و سپس نقش ميتوکندري در مسير اپوپتوز بررسي ميشود:
VDAC3: کانال کلسيمي موجود در غشاي خارجي ميتوکندري است.
UP4: کانال يوني انتخابگر نسبت به يون کلسيم که يون کلسيم را به درون ميتوکندري وارد ميکند. اين کانال يون کلسيم را در جهت گراديان شيميايي عبور ميدهد.
هر دو کانال ذکر شده فعاليت وابسته به کلسيمي را نشان ميدهند که در کنترل هموستاتيک غلظت يون کلسيم سيتوپلاسمي نقش دارند. کلسيم ورودي به ماتريکس ميتوکندري (قسمت داخلي ميتوکندري)، CSMDH را تحريک ميکند که براي توليد ATP نياز است. خروج کلسيم از طريق غشاي داخلي از طريق تبادلگر (Na+/Ca2+ و H+/Ca2+) انجام ميشود. مسير PTP که از هر دو غشا عبور ميکند که به عبور آزادانه کلسيم کمک ميکند. کاهش تعادل شار کلسيمي خروجي و ورودي در غشاي پلاسمايي سلول منجر به افزايش غلظت کلسيم سيتوپلاسمي از 100 نانومولار به بيش از 1 ميکرومولار شده و يک افزايش پيشرونده در بالارفتن کلسيم در ميتوکندري القا ميکند. زماني که مقدار زيادي کلسيم در ماتريکس ميتوکندري تجمع يابد يون کلسيم با Cytophilin D واکنش ميدهد و مسير PTP باز ميشود. بنابراين افزايش غلظت کلسيم توليد فاکتورهاي نظير ROS و اسيد چرب آزاد را تحريک ميکند که باز شدن PTP را تشويق ميکند.
باز شدن PTP منجر به ايجاد اختلاف گراديان و آزادسازي کلسيم ميشود. اگر افزايش غلظت کلسيم درون سيتوزول باقي بماند مسير PTP باز ميماند و اجازه تجمع محلول در ماتريکس را ميدهد. اين باعث افزايش فضاي ماتريکس و تخريب غشاي خارجي آن و آزادسازي محتواي بين دو غشا ميشود. در نهايت اختلال در عملکرد ميتوکندري و فعال سازي مکانيسم هاي سيتوپلاسمي با آزاد سازي فاکتورهاي ميتوکندري منجر به مرگ سلول ميشود.
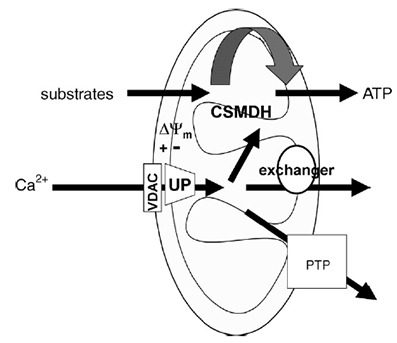 تصوير -3 شماتيک ميتوکندري و مسيرهاي تبادل يون کلسيم
تصوير -3 شماتيک ميتوکندري و مسيرهاي تبادل يون کلسيم
شبکه اندوپلاسمي
تحريک فيزيولوژيک ميتواند تخليه کلسيم از ذخاير شبکه ER را به صورت جزئي و گذرا فعال کند و به نظر ميرسد که Bcl-2 ميتواند کاهشي جزئي در غلظت کلسيم ER براي حفظ بقاي سلول ايجاد کند. تخليه زياد ذخاير کلسيم در ER ميتواند يک استرس به ER وارد کرده و منجر به شروع اپوپتوز شود.
سرطان
تنظيم سيگنالينگ درون سلولي نقش مهمي در تکثير سلول هاي سالم و سرطاني دارد. در سلول اپيتليال سالم، غلظت کلسيم آزاد براي ورود به سلول و به انجام رساندن فاز S و M در چرخه سلولي ضروري است. آنها به طور متضاد در سلول هاي سرطاني ميتوانند از اين دو فاز چرخه سلولي با غلظت کمتري از کلسيم آزاد درون سيتوپلاسيمي عبور کنند که نشان ميدهد که به منظور افزايش سنتز DNA و ميتوز سريع سلول هاي سرطاني تکرار شونده، يک مکانيسم جايگزين براي براورده ساختن نياز به کلسيم درون سلولي توسعه داده اند. جزييات اين مکانيسم تا سال چاپ مقاله (2008) نامشخص است.
با اين حال شواهد بيان ميکند که بيان کانال کلسيمي نوع T به طور غيرعادي انجام شده است و بلاک کردن اين کانال ها ممکن است تکثير سلول ها را کاهش دهد و حتي اپوپتوز را القا کند. چون کانال نوع T در سلول هاي اپيتليال بيان نشده است بنابراين از روش بلاک کردن اين کانال ميتوان براي درمان سرطان آن ناحيه استفاده کرد.
يون هاي کلسيم درون سلولي به عنوان پيغامبر ثانويه براي تنظيم بيان ژن، تکثير سلول، مهاجرت و مرگ نقش دارند. تغييرات کلسيم در ايجاد تومور، رگزايي، پيشرفت و متاستاز آن دخالت دارد.
سيگنال هاي کلسيم درون سلولي به سه دسته موجپ (Wave)، اسپايک و نوسان (Oscillation) دسته بندي ميشوند. اين سيگنال ها بايد از نظر زماني و مکاني به طور دقيق کنترل شوند. از بين اين سه دسته نوسانات کلسيم نقش بيشتري در انتقال اطلاعات بيولوژيکي درون سلول دارند. به طور مثال نوسانات کلسيمي، سيگنالهاي ضروري را براي تکثير به سلول هاي سرطاني Esophageal ميرسانند. به منظور تکثير با نرخ بالا، افزايش تحرک و تهاجم سلولي، فرار از مرگ و فريب حمله ايمني و … تومور سيگنالينگ کلسيم خود را مجدداً مدل سازي ميکند.
به طور ويژه فرکانس، دامنه و مدت زمان (Duration) اين نوسانات درون سلولي کدهاي کلسيمي خاصي را براي فعال سازي انتخابي فاکتورهاي رونويسي بيان ژن ايجاد ميکند. رمزگشايي کدهاي فرم نوساني توسط افکتورهاي درون سلولي شامل CaM،NFAT،NF-Kβ، CaMKII و Calpain انجام ميشود. اين افکتورها در سرعت باز و بسته شدن (خاموش/روشن شدن) براي کلسيم و راهاندازي فرايندهاي سلولي مختلف متفاوتاند. اندازه، سينتيک، پروفايل مکاني سيگنال کلسيمي مشخص ميکند که چه فرايندي ، چه زماني رخ دهد و چه مدت طول بکشد. فرکانس نوسانات ميتواند از ده ها هرتز در نورون به دهها ميليهرتز در سلول هاي تحريک پذير برسد. اين فرکانس نوسان به ميزان تحريک اعمال شده بستگي دارد. اطلاعات ميتواند به دو صورت مدولاسيون فرکانس و مدولاسيون دامنه منتقل شود. مدل سازي رياضي پروتئين حساس به کلسيم نشان ميدهد که ميتوان سيگنال نوساني کلسيم را بر اساس فرکانس، دامنه و يا زمان گذر آن رمزگشايي کرد.
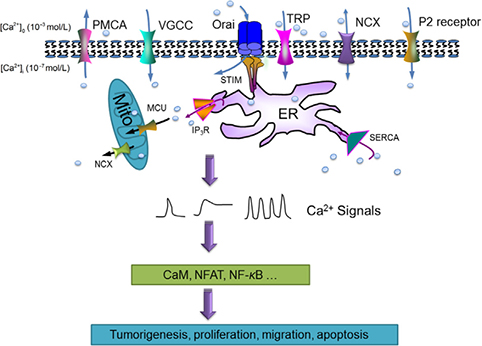
تصوير – 4 سيگنالينگ کلسيم در سرطان
سلول بنيادي و سيگنال کلسيمي
سيگنال هاي مکانيکي تنظيمکنندههاي مهم هوموستاز اسکلتي هستند، و جريان نوساني سيال ناشي از کشش، يک محرک مکانيکي قوي است.
اگر چه مکانيزم هايي که Osteoblasts و Osteocytes به جريان سيال پاسخ ميدهند روشن است، اما مکانيسم هايي که سلولهاي بنيادي Mesenchymal حاصل از مغز استخوان به چنين تحرکي پاسخ ميدهند، کمي ناشناختهاند. در اينجا نشان داده ميشود که آبشارهاي سيگنالينگ داخل سلولي فعال شده توسط جريان سيال در سلول هاي بنيادي مزانشيمي انسان شبيه به آنهايي است که در سلول هاي استئوبلاستيک فعال شدهاند. جريان هاي نوساني سيال القاء تنش برشي 5، 10 و 20 dyn/cm2 باعث افزايش سرعت وابسته به جريان در جريان کلسيم داخل سلولي ميشوند. استفاده از جريان مايع نيز باعث القاي فسفوريلاسيون کيناز-1 و -2 ، سيگنال رگولاتورهاي خارج سلولي و همچنين فعال شدن پروتئين phosphatase calcineurin حساس به کلسيم در سلول هاي بنيادي مزانشيمي ميشود. فعال کردن اين مسيرهاي سيگنالينگ منجر به افزايش تکثير سلولي شده است.
به طور خلاصه، اين مطالعه براي اولين بار مکانيزم درون سلولي را نشان ميدهد که در آن نوسان جريان سيال بر سلول هاي بنيادي مزانشيمي انساني تأثير ميگذارد. نشان داده شد که جريان مايع موجب افزايش تکثير سلول هاي HMSC از طريق مکانيزمي ميشود که احتمالاً از طريق فعاليت PLC و PK باعث افزايش غلظت يون کلسيم ميشود و ERK1 / 2 را فعال ميکند. اين داده ها نشان ميدهد که يک مسير معمول وجود دارد که سيگنال هاي مکانيکي به پاسخهاي سلولي تبديل ميشود. روشنتر شدن اين پيچيدگي هاي اين مسير ممکن است منجر به توسعه تکنيک هاي جديد درماني شود که به منظور ارتقاء استفاده از Osteoprogenitors و کاهش از دست رفتن استخوان کمک ميکند.
افزايش تنش برشي باعث افزايش تعداد سلول هايي که پاسخ دادهاند و افزايش غلظت يون کلسيم آزاد شده ميشود. منشأ اين افزايش غلظت کلسيم را با استفاده از داروهاي مهارکننده بررسي ميکنند به طور مثال از Gdcl3 Or Verapamil استفاده ميشود تا کانالهاي کلسيمي نوع L و کانال هاي کاتيون حساس به عوامل مکانيکي را مسدود کند و سپس آزمايش را مجدداً تکرار ميکنند و نتيجه اين بود که اين کانال ها تاثيري در نتيجه نداشته اند اما با مهار پمپ هاي کلسيمي وابسته به ATP پي بردند که ذخاير کلسيم درون سلولي منشأ افزايش غلظت يون کلسيم در پاسخ به جريان سيالاند. همچنين براي مطالعه بيشتر فعاليت PLC را محدود کرده که توليد IP3 را متوقف کنند و مشاهده شد که اين اتفاق بر روي نتايج تأثير دارد (توقف توليد IP3 معادل با کاهش پاسخ سلولي و غلظت يون کلسيم آزاد شده در اثر جريان سيال است).
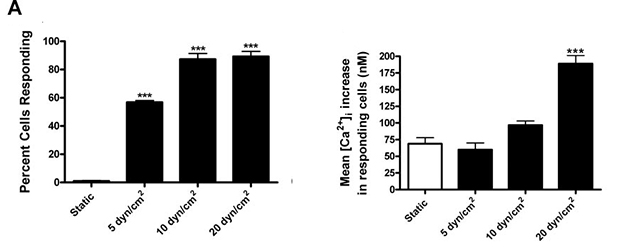
تصویر 5- تغییرات کلسیم و پاسخ سلولى با تغییر تنش برشى
منابع
1- Berridge, M.J., M.D. Bootman, and H.L. Roderick, Calcium signalling: dynamics, homeostasis and remodelling. Nature reviews Molecular cell biology, 2003. 4(7): p. 517-529.
2- Berridge, M.J., Calcium signalling remodelling and disease. 2012, Portland Press Limited.
3- Michal, G. and D. Schomburg, Biochemical pathways: an atlas of biochemistry and molecular biology. 1999: Wiley New York.
4- Roderick, H.L. and S.J. Cook, Ca2+ signalling checkpoints in cancer: remodelling Ca2+ for cancer cell proliferation and survival. Nature Reviews Cancer, 2008. 8(5): p. 361-375.
دیدگاه ها